배터리 기본지식
한국앤컴퍼니 ES 사업본부에서는 고객님의 배터리 관리를 효율적으로 지원하기 위하여
기본 지식부터 운영/관리 방법까지 다양한 정보를 제공하고 있습니다.
기본 지식
납 축전지의 정의 및 원리
(Lead-Acid Battery)
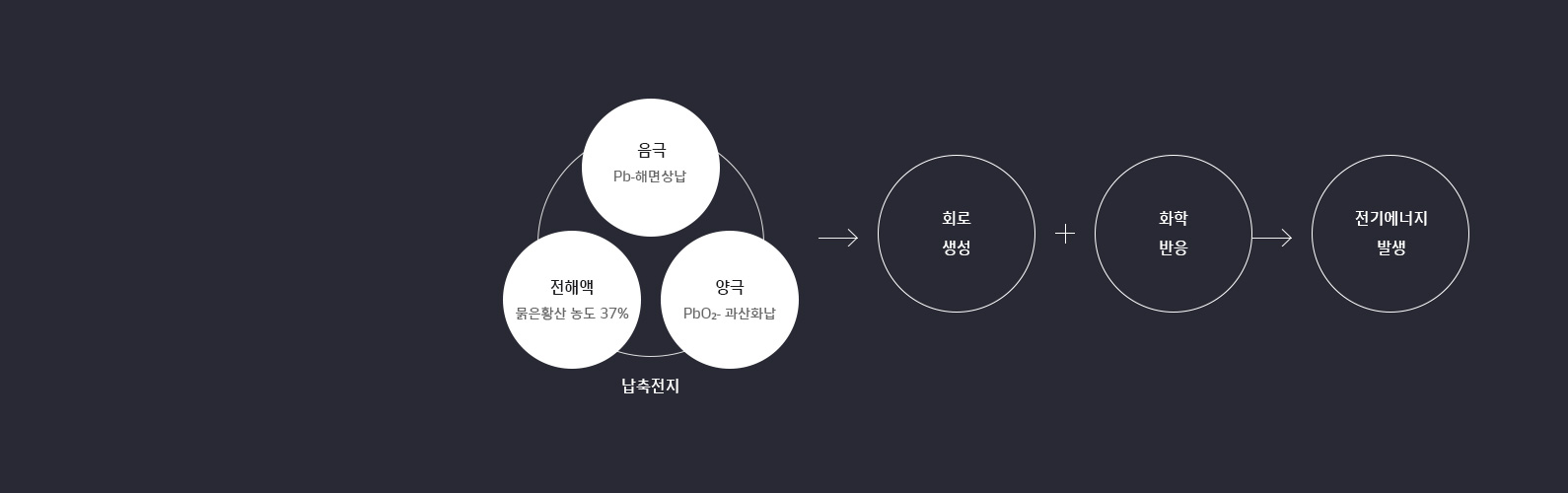
납 축전지란, 납(Lead)과 묽은 황산(Acid)으로 구성된 축전지로 이온화 경향이
큰 음극(Pb-해면상납)과 이온화 경향이 적은 양극(PbO2-과산화납)을
전해액(묽은 황산 농도 = 37%)에 넣어 회로를 만들고 화학 반응을 통해 전기에너지를
발생시키는 축전지를 말합니다.
방전(Discharge) / 충전(Charge) 중
화학 반응
전해액은 묽은 황산(H2SO4 + H2O)으로 화학반응 중에는
황산만 반응하여 물에 가까워져 Battery가 방전 함에 따라 전해액 비중과
전압은 점차 낮아지고 계속해서 방전하면 활물질이 황산납(PbSO4)으로
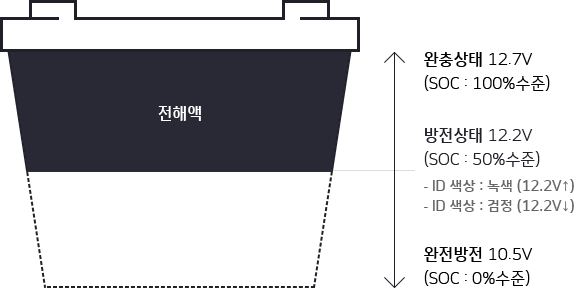
변하여 더 이상 전기를 발생할 수 없는 완전방전 상태가 됩니다. 만일,
일정 전압 이하로 과도하게 방전시키면 Battery는 내부 충격을 입어
수명 단축의 원인이 되기 때문에 자동차용 Battery는 통상
10.5V(1.75V / Cell)까지만 방전 시킵니다.
전해액중의 물이 다시 묽은 황산(H2SO4 + H2O)으로 점차 되돌아가는
과정으로 전해액 비중과 전압이 규정치까지 상승합니다. 충전이 진행되어
완전충전 상태가 되면 전해액 비중과 전압은 더 이상 상승하지 않고 물의
전기 분해가 가속화되어 수소(H2)와 산소(O2) Gas가 심하게 발생됩니다.
특히 충전 말기와 고율 방전 시에 Gas 발생이 활발한데 수소는 파열성을
가지고 있고 산소는 연소를 돕는 역할을 하므로 충전 중에는 Battery 근처에
화기를 엄금해야 합니다.